| 拞榓擬偺應掕 |
| 拞榓擬偺應掕 |
丂巁偲墫婎乮傾儖僇儕乯偺拞榓斀墳偼丆彫丒拞妛峑偱傕埖偭偰偄傞尰徾偱傎偲傫偳偺惗搆偑抦偭偰偄傞丅
丂偟偐偟丆俫+傗俷俫-側偳偺僀僆儞傗丆拞榓斀墳帪偵敪擬偑偁傞偙偲偼妛廗偟偰偄傞偼偢偱偁傞偑丆偙傟傜偺抦幆偼偁傑傝惗搆偵掕拝偟偰偄側偄丅傑偨丆巁丒墫婎偺扨尦偼斀墳擬偺屻偱偁傞応崌偑懡偄丅偟偨偑偭偰丆拞榓斀墳傗偦偺検揑娭學偵偮偄偰娙扨偵愢柧偟偰偐傜幚尡偵擖傞昁梫偑偁傞丅
丂侾mol/L偲斾妑揑擹搙偺崅偄NaOH悈梟塼傪拲幩婍偵擖傟偰埖偆偺偱丆師偺拲堄揰偼嫮挷偟偰偍偒偨偄丅
丂嘆丂NaOH悈梟塼乮堦斒偵傾儖僇儕偺悈梟塼乯偼,恖懱偵桳奞偱偁傞丅
丂丂丂摿偵栚偵擖偭偨応崌偵丆妏枌偑梟偗傞側偳偺婋尟惈偑偁傞偺偱丆
丂丂丂愨懳偵拲幩婍傪恖偵岦偗側偄丅
丂嘇丂幚尡帪偵偼儊僈僱傑偨偼曐岇儊僈僱傪偡傞丅
丂傑偨丆斀墳擬偺幚尡偱偼廃埻偵擬偑摝偘側偄傛偆偵偡傞昁梫偑偁傞丅
丂偙偺幚尡偱偼巊梡偡傞梟塼偺検偑彮側偄偺偱丆
丂巗斕偺敪朅僗僠儘乕儖梕婍偱偼擬偺摝偘偑戝偒偄丅
丂偦偙偱丆岥偺彫偝偄抐擬梕婍傪帺嶌偟乮彫宆娙堈擬検寁乯巊梡偡傞丅
丂丂丂丂![]()
![]()
![]()
乮侾乯婍嬶丒帋栻婍嬶丗 | |
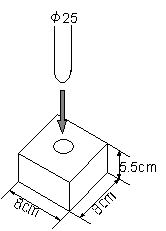 丂丂丂應掕梕婍 丂丂丂應掕梕婍 |
乮俀乯彫宆娙堈擬検寁偺惢嶌嘆丂岤偝5.5cm偺敪朅僗僠儘乕儖偺斅傪梡堄偡傞丅 |
丂丂丂丂丂![]()
![]()
![]()
丂丂
乮侾乯拞榓擬偺愢柧
侾乯丂巁偵偼俫+僀僆儞丆墫婎偵偼俷俫-僀僆儞偑娷傑傟偰偄傞
丂丂偙偲傪娙扨偵愢柧偡傞丅
俀乯丂偝傜偵丆埲壓偺傛偆側偙偲傪愢柧偡傞丅
乲拞榓擬乴
丂巁偺俫+偲墫婎偺俷俫-偑斀墳偟偰丆侾mol偺悈偑偱偒傞偲偒偺斀墳擬
乮拲乯拞榓斀墳丂仺丂巁偺俫+偲墫婎俷俫-偐傜悈偑偱偒傞斀墳
丂丂丂俫+亄俷俫- 仺 俫2俷
偲側傞偺偱丆
俫+(mol) 亖俷俫-(mol) 亖俫2俷(mol)
偺娭學偑偁傞丅偟偨偑偭偰丆拞榓擬偼丆
乽侾mol偺俫+偑斀墳偡傞偲偒偺斀墳擬乿偲昞尰偟偰傕
乽侾mol偺俷俫-偑斀墳偡傞偲偒偺斀墳擬乿偲昞尰偟偰傕
乽侾mol偺俫2俷偑惗惉偡傞偲偒偺斀墳擬乿偲昞尰偟偰傕
摨偠偙偲偵側傞丅
俁乯丂杮幚尡偱偼丆墫巁偲悈巁壔僫僩儕僂儉悈梟塼偺拞榓擬丆偡側傢偪師幃偺俻偺抣傪媮傔傞偙偲傪栚昗偲偡傞丅
丂俫俠倢aq亄俶倎俷俫亖俶倎俠倢aq亄俫2俷亄俻丂
乮俀乯拞榓擬偺應掕 侾乯丂娙堈擬検寁偵1.00 mol/L HCl 10.0 mL傪擖傟丆
丂丂丂壏搙應丂掕偟丆昞偵婰擖偡傞丅
俀乯丂50mL價乕僇乕偐傜NaOH悈梟塼傪拲幩婍偱俀 mL庢傝丆丂丂丂丂丂1)偺娙堈擬検寁偺拞偵擖傟傞丅
丂丂丂壏搙寁偱寉偔偐偒崿偤墫巁偲拞榓斀墳偝偣傞丅
丂丂丂偦偺屻壏搙傪應掕偟丆昞偵婰擖偡傞丅
俁乯丂埲壓俀乯偲摨條偵偟偰丆NaOH悈梟塼傪俀 mL偢偮壛偊丆
丂丂丂偦偺偮偳壏搙傪應掕偟昞偵婰擖偡傞丅
係乯丂NaOH悈梟塼傪寁16 mL壛偊偨偲偙傠偱丆幚尡傪廔椆偡傞丅
丂乲壏搙偺婰榐昞乴丂仚應掕抣偺椺
乲拲乴壏搙偼彫悢揰埲壓戞侾埵傑偱撉傓偙偲丅
NaOHaq 0mL 2mL 4mL 6mL 8mL 壏搙乲亷乴 25.3 27.3 28.6 29.8 30.5 NaOHaq 10mL 12mL 14mL 16mL 壏搙乲亷乴 31.1 30.3 29.8 29.3
僌儔僼偺椺
乮俁乯僌儔僼偺嶌惉
侾乯丂僌儔僼梡巻偺佀偲仺偺娫偵丆
丂丂丂NaOH悈梟塼侽mL偺偲偒偺壏搙傪仜報偱僾儘僢僩偡傞丅
丂丂丂佀偲仺偵揔摉側壏搙傪婰擖屻丆
丂丂丂侾亷偒偞傒偱僌儔僼偺廲幉偵壏搙栚惙傝傪婰擖偡傞丅
乲椺乴丂壏搙偑21.3亷偱偁傟偽丆佀傪21亷丆仺傪22亷偲偟丆
丂丂丂丂侾亷偒偞傒偱21亷偐傜29亷傑偱
丂丂丂丂廲幉偵壏搙栚惙傝傪晅偗傞丅
俀乯丂昞偺壏搙傪慡晹仜報偱僾儘僢僩偟丆慡懱傪側傔傜偐偵幚慄偱寢傇丅
乮係乯幚尡偺傑偲傔
師偺傛偆側庤弴偱寁嶼偝偣傞丅
1) 嵟崅壏搙偵払偟偨偲偒偺師偺抣傪寁嶼偣傛丅
媮傔傞抣 寁嶼椺 梟塼偺懱愊
俫俠倢aq亄俶倎俷俫aq10ml亄10m
丂亖20mL壏搙曄壔 儮倲亖31.1亅25.3
丂丂亖5.8亷亖5.8俲敪惗偟偨擬検
梟塼偺斾擬們偼4.18J/(g丒俲)
梟塼偺枾搙偼1.0g/mL俻亖倣們儮t
丂亖20亊4.18亊5.8
丂亖485J亖0.485kJ斀墳偟偨墫巁偺暔幙検 1.00mol/L亊10/1000L
丂亖0.0100mol
俀) 墫巁偑侾mol斀墳偟偨偲偒偺擬検乮拞榓擬乯俻傪媮傔傛丅
丂丂0.0100mol丗侾mol亖俻丗0.485kJ
丂 亪 俻亖48.5kJ
丂丂丂丂丂丂丂![]()
![]()
丂丂丂
丂師偺傛偆側揰傪惗搆偵拲堄偝偣傞丅
丂丒丂壛偊傞NaOHaq丂俀mL偼丆拲幩婍偺栚惙傝偱偒偪傫偲寁検偟丆偙傏偝側偄傛偆偵擖傟傞丅
丂丒丂俀ml偢偮壛偊偰壏搙傪應掕偡傞帪娫娫妘偼丆傎傏摨偠偵側傞傛偆偵怱妡偗傞丅
丂丂丂丂丂丂丂![]()
![]()
| 丂1)丂曐嶁弮嶰丆壢妛偺幚尡丆28,236(1977) 丂2) 嵅媣娫岝堦丒嵅摗婌堦丆壢妛偺幚尡丆27,518(1976) 丂 |
丂丂丂丂丂栠傞丂丂丂丂丂