| エタノールの脱水 |
| エタノールの脱水 |
この実験は,一連の操作でジエチルエーテルとエチレンを連続して簡単に生成し,
反応温度と生成物の関係を調べるだけでなく,教科書等には書かれていない
反応条件を知って化学反応の面白さ奥深さを体験する演示実験である。
![]()
![]()
![]()
(1)器具・試薬器具: | |
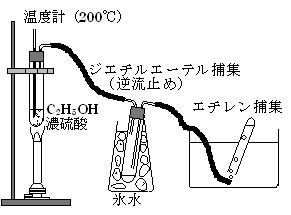 |
装置の概略は図のようである。 |
![]()
![]()
![]()
(1)事前操作
1)試験管(24mmφ)にエタノール 10mlをとり,濃硫酸 6mlを少しずつ加えながら試験管を振り液をよく混ぜる。
2)混ぜ終えたら試験管の底を手で触れさせる。
「あっちっちっ!」
「反応熱だよ。混ぜただけで,反応が起こっているんだね。これを加熱したらどうなるだろう。」
(2)ジエチルエーテルの生成 3)沸騰石を数粒入れ,図のように装置を組み弱い火で加熱を開始する。
「温度はどうなるかな?」
4)生徒を指名し温度を読んでもらう。温度が上がり,沸騰が激しくなると,蒸気が誘導管を通るようになる。
「盛んに沸騰しているのに,誘導管の先端からは,初めに気体が少し出ただけで(空気),今はほとんど出てないね。蒸気はどこへ行ってしまったんだろう?」
5)冷却している試験管を持ち上げ中を見せる。液がたまっている。
「蒸気はここで凝縮していたんだね。エタノ−ルが蒸留されたのかな。温度は何℃?,変化は?」
「約130℃,さっきより温度変化が少ない。けれど,少しずつ上がっている。」
(3)エチレンの生成
6)加熱をこのまま続ける。
「加熱をこのまま続けてみよう,いつまでも同じかな?」
「あっ!温度が上がりだした。誘導管の先端から気体が発生し始めた。温度は150℃位かな?・・・・」
「気体を捕集しよう」
「気体が激しく発生,温度は160℃。」
「1本目捕集完了,ゴム栓をして・・・。2本目も完了」
「わあすごい,3,4,5本目も一気に捕集できちゃった。すごい勢いで気体が出てるね,温度は170℃。」
「また温度が上がりだした。反応液が残り少ないから,もう加熱をやめようか。」
「逆流しないように,誘導ゴム管の先を水から出してから火を止め,生成物がなんだか調べよう。」
7)逆流しないように,誘導ゴム管の先を水から出し,火を止める
(4)ジエチルエーテルの確認
1)液体生成物のにおいを嗅ごう,エタノールかな。
「エタノールじゃない。」
2)試験管をお湯につけよう。また,液体生成物の少量を手の甲につけてみよう。
「じきに沸騰が始まった,手につけるとスーっとする。揮発しやすい,沸点が低いんだ。」
3)液体生成物とほぼ同量の水を加えてみよう。
「水に溶けない。上にあるから水より軽いんだ。」
(5)エチレンの確認
1)捕集した気体に点火しよう,燃えるかな?
(ゴム栓をはずしてガスマッチの火を近づける)。
「管口付近で燃えている。試験管を上に向けても下に 向けても炎の大きさはほとんど同じだ。空気と密度が あまり変わらないみたい。」
2)臭素水2mlを入れて,よく振ってみよう。
「臭素の色がすぐに消えた,不飽和結合があるのかな。」
![]() 説
説
130〜140℃では主としてジエチルエーテルが,
160〜170℃では主としてエチレンが生成する。
濃H2SO4
2C2H5OH → C2H5OC2H5+H2O
130〜140℃
濃H2SO4
C2H5OH → C2H4+H2O
160〜170℃
アルコールの2分子脱水(縮合)および1分子脱水(脱離)反応であるが,
濃硫酸を加熱することなどが敬遠されてか,実際に実験を行っているところは少ないらしい。
実際にエタノールと濃硫酸の混合物を加熱しても130〜140℃や160〜170℃にすることが
意外に難しいのも敬遠される理由かも知れない。
反応温度を保つには,それなりの条件が必要なのである。
1 ジエチルエーテルの生成
反応液(エタノールと濃硫酸の混合物)の温度を130〜140℃または160〜170℃に保つのは加熱の強さではなくエタノールと濃硫酸の割合である。エタノールが濃硫酸の2倍以上あったら温度は130℃に達しないし,160℃を超えるのはエタノールが濃硫酸より少ないときである。
加熱時,エタノールが濃硫酸の2倍以上あると,沸騰は130℃以下で起こり始め,温度は次第に上昇する。このとき留出する液体はほとんどエタノールである。温度が上がって130℃に達する頃にはエタノールは濃硫酸の2倍以下になっていて,沸騰はきわめて盛ん。このとき主として生成するのがジエチルエーテルである。ジエチルエーテル生成中の温度上昇は激しい沸騰のため緩やかである。このとき水上置換用の試験管に気体は溜まらない。
2 エチレンの生成
エタノールが減り濃硫酸との割合が1:1に近づくと温度はふたたび速やかに上昇し,150℃を超える頃からエチレンが発生し始める。160〜170℃の間はエチレンの発生が激しく,温度上昇は緩やかである。
液が減るにつれてふたたび温度上昇が激しくなり,190℃以上は熱濃硫酸の酸化作用の領域だ。反応液も黒く汚れ,SO2の発生など別の面倒も増えるから,その前に反応を止めよう。火を止めるときは間違っても,熱濃硫酸に水を逆流させるようなことはしないようにしたい(誘導管先端を水面から出した後,火を止める)。
3 ジエチルエーテルの確認
ジエチルエーテルは沸点34℃の水に溶けにくい液体。だから留出物の匂い,沸騰,水との分離などでエタノールとは違う物質であることを調べている。エタノールと比較しながらやれば効果的。
4 エチレンの燃焼
エチレンは空気とほぼ同じ分子量なので試験管の向きにかかわらず,気体が出にくく炎は観察しずらい。空気を70%ほど入れ,十分混合してから爆発させてもよい。
C2H4 + 3O2 → 2CO2 + 2H2O
5 臭素水について
臭素水は不飽和結合の検出に便利だが,付加生成物はCH2BrCH2Brではないとの指摘もあり,深入りは避けたい。 臭素水の脱色に熱濃硫酸が分解したSO2が関わると考える向きもあるらしいが,水上置換もしているし,万一あってもそれは僅か。脱色の中心はエチレンだから,脱SO2などは必要ない。
![]()
![]()
・反応液が早めに黒くなるのは,濃硫酸が試験管底部に淀んでいるからである。初めに反応液をよく混合しておけば避けられる。
・エチレンは水に溶けにくい気体なので,臭素の付加反応を見るには,試験管をよく振り水溶液中の臭素と触れ合うようにすることが大切である。なお,速やかな脱色を観察するには臭素水が濃すぎない方がよい。
◇ 参考 ◇
臭素水の脱色に熱濃硫酸が分解したSO2が関わると考える向きもあるらしいが,万一あってもそれは僅か。脱色の中心はエチレンだから,脱SO2などは必要ない。
![]()
![]()
| このページのもとは,岸田功,化学と教育,50,34(2002) |