| ファラデー定数の測定 |
| ファラデー定数の測定 |
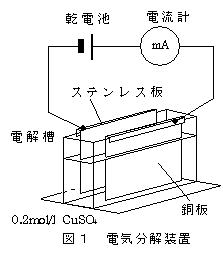
この実験は陽極に銅板,陰極にステンレス板を用いて硫酸銅水溶液を電気分解して,
ファラデー定数を求める実験を,乾電池1本で行おうとするものである。
陽極;Cu→Cu2++2e−
陰極;Cu2++2e−→Cu
電気分解中,陽極で溶け出す銅と陰極で析出する銅の量が同じなので,
溶液中の銅イオンの濃度は変わらない。
だから電極面積と電極間の距離を変えなければ,電圧を一定にすれば流れる電流もほぼ一定である。
このとき電極間の距離が1cm程度なら,乾電池1本の電圧でも測定に十分な電流が得られるのである。
使用する硫酸銅水溶液は,0.2 〜0.5 mol/l溶液を約10 ml(濃度によって電流の大きさが変わる)。
電源は単一マンガン乾電池1本,電流200〜500mA,電解時間10〜30分で,
誤差数%以内の測定ができる。
また,陰極にステンレス板を用いることで,色の変化から析出した銅を直接目で確認できるだけでなく,
実験終了後ステンレス板に付着した銅箔をピンセットではがして銅の付着を実感することができる。
電気分解の実験で,大げさな電源装置は必要ない。
分解電圧は小さいし,電気量は8クラスの生徒実験でも単一乾電池1本で十分間に合うことが多い。
これを通して,高校で行う電気分解の実験の電源は,
乾電池1〜2本だけで十分であることを実感してもらいたい。
![]()
![]()
![]()
 |
(1)器具・試薬器具: |
 |
*1 |
![]()
![]()
![]()
(1)電極の前処理
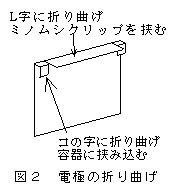
1)両電極を,電解槽にしっかり挟み込み,0.2 〜0.5 mol/l 硫酸銅(Ⅱ)水溶液約10 mlを入れ(深さ1.5〜1.8cm),電流計(500mA端子)と乾電池をつなぐ(銅は陽極,ステンレスは陰極)。約5分間電流を通じてから,ステンレス電極側のミノムシクリップをはずし,電気分解を終える(この操作により電極が活性化され,本番で一定の電流が得られるようになる)。
(2)電極の質量測定1 2)ステンレス電極を取り出し,表面の硫酸銅(Ⅱ)溶液を水洗してからティッシュペーパーで水気を拭い,質量を1 mgの単位まで測定する。
電極の質量1 m1 g
(3)電気分解(電解時間と電流の測定)
3)電気分解(電解時間と電流の測定) ふたたびステンレス電極を電解槽にしっかり挟み込み,ミノムシクリップを電極につなぎ約10〜30分間電流を通じ,電解時間と電解中の電流を時々測る。電気分解を終了するときは,ステンレス電極側のミノムシクリップをはずす。
電解時間 t s
電流 i A
(4)電極の質量測定2
4)ふたたびステンレス電極を取り出し,水洗してからティッシュペーパーで水気を拭い,質量を1 mgの単位まで測定する。
電極の質量2 m2 g
(5)析出した銅の確認と片付け
5)析出した銅の確認 ステンレス電極上の銅は陽極に対面する側だけにほとんど析出する。これをピンセットを使ってはがしてとる。
6)硫酸銅水溶液は回収して再使用する。電極,電解槽はすぐ洗う。
(6)結果の処理
実験例 0.2mol/l CuSO4 10mlを使って10分間電気分解した。。
電極の質量 m1=3.549 g,m2=3.594 g
質量差 m=3.594−3.549=0.045 g
電解時間 t =10.00分=600 s
電流 i =231 mA=0.231 A
1)通じた電気量はいくらか
解)電気量〔C〕=電流〔A〕×時間〔s〕だから,
通じた電気量qは、q=i × t =0.231 A×600 s=138.6 C
2)陰極でCu 1molを得るのに必要な電子は何molか。
解)陰極での反応は Cu2++2e−→Cu だから2mol。
3)この実験では電子何molを通じたことになるか。
解)原子量をCu=63.5として,析出した銅の物質量は
n=0.045g÷63.5g/mol。
電極でやりとりされた電子は析出した銅の2倍だから,電子の 物質量は
ne=(0.045/63.5)mol×2=1.417×10−3 mol
4)ファラデー定数 F〔C/mol〕を求めよ。
解)ファラデー定数〔C/mol〕=電気量〔C〕÷電子の物質量〔mol〕だから,
F=138.6 C/(1.417×10−3) mol
= 97790 ≒ 9.78×104 C/mol
5)ファラデー定数の文献値は F=9.65×104〔C/mol〕である。君たちの実験結果と比較し,誤差を求めよう。
解)次式より誤差は1.3%で,概ねよい結果だろう。
{(9.78−9.65)×104}/(9.65×104)=0.013
![]() 説
説
銅が定常的に陽極で溶解し,陰極で析出する状態にするのが前処理である。これを行わないと,時間とともに電流値が変わる。この前処理は陰極が銅であっても必要である。
2 電極の質量測定
理論的には陽極の溶解量と陰極の析出量は全く同じはずである。しかし実際はいつも陽極の方が少しだけ多い。電解後,溶液中に微細な銅粉やCuOがかすかに見られる。ファラデー定数を求めるには,陰極の析出量を測定するほうがよい。
3 実験誤差について
析出量を増やすと,誤差率を減らすことができるので,測定が楽になる。
たとえば,他の条件を変えずに次のことを行うのである。
(ア) 電解時間を10分から30分に長くする。
(イ) 溶液の濃度を0.2 mol/lから0.4 mol/lに上げる。
(ウ) 電解槽をpH試験紙容器の蓋から身に変えて,より大きな面積の電極を使う。
なお,電流を多く通じるために,安易に電圧を上げるのは避ける。水など他の物質が同時に電気分解されることがあるからである
![]()
![]()
誤差の原因をできるだけ排除することが大切だ。
この実験で,滑り抵抗器を使わないのもその例である。
・電極間距離や電極面積により電流が変化するから,電極が動かないように固定する。
・銅板やミノムシクリップの接触部分の錆をよく落としておくことも大切である。
・質量測定では,電極表面の硫酸銅水溶液を洗い落としてから水気を拭き取るが,
析出した銅をはがさないよう電極をあまり強くこすらない。
電極に水滴が残ることがないよう表裏をよく目視することも大切である。
・陰極は銅板でもいいが接着性がよいので,析出した銅をピンセットで剥がしとることはできなくなる。
![]()
![]()
| このページのもとは,岸田功,化学と教育,50,702(2002) 1) 赤堀,木村他 化学実験事典 499(1968) 講談社 2) 西川友成 化学と教育 35,350(1987) 3) 石井&K.M. 化学と教育(お答えします) 34,298(1986) 4) Shakhashiri(池本訳) ケミカルデモンストレーション6 振動反応と時計反応 97(1998) 丸善 |